Серная кислота (H2SO4) является одной из самых распространенных и важных кислот в химии. Она обладает высокой степенью кислотности и широко применяется в различных отраслях промышленности и научных исследованиях. Производство серной кислоты осуществляется путем окисления сероводорода или природных сульфидов, таких как пирит, с помощью кислорода или оксида азота. Серная кислота имеет множество свойств и взаимодействий, одним из которых является ее реакция с хлоридом калия.
Хлорид калия (KCl) представляет собой соль, состоящую из ионов калия (K+) и хлора (Cl-). Эта соль является бесцветным кристаллическим веществом, которое хорошо растворяется в воде. Хлорид калия имеет широкое применение в сельском хозяйстве, медицине и других отраслях промышленности. Он используется в качестве пищевой добавки, удобрения, регулятора давления в стеклянных изделиях и многого другого.
Когда серная кислота взаимодействует с хлоридом калия, происходит химическая реакция, которая приводит к образованию двух продуктов: серной соли и соляной кислоты. Реакция можно представить следующим уравнением:
H2SO4 + 2KCl → K2SO4 + 2HCl
Таким образом, серная кислота и хлорид калия образуют серную соль K2SO4 и соляную кислоту HCl. Эта реакция имеет важное промышленное значение и используется для получения серной соли и других соединений серы.
Взаимодействие серной кислоты и хлорида калия
Серная кислота (H2SO4) и хлорид калия (KCl) могут взаимодействовать, образуя новые соединения и проявляя определенные свойства.
При взаимодействии серной кислоты и хлорида калия образуется кислотный соль - серный калий (K2SO4), который представляет собой белый кристаллический порошок. Формула этого соединения говорит о наличии двух атомов калия (K), одного атома серы (S) и четырех атомов кислорода (O). Серный калий обладает рядом свойств, характерных для солей - он растворяется в воде и образует щелочные растворы.
Взаимодействие серной кислоты и хлорида калия сопровождается реакцией нейтрализации, в результате которой образуются ионы серы, ионы калия и молекулы воды. При этом происходит обмен протонами, что приводит к образованию соли и воды:
| Реагенты | Реакция | |||||
|---|---|---|---|---|---|---|
| H2SO4 | + | 2KCl | = | K2SO4 | + | 2HCl |
Кислотный хлорид (HCl), который образуется в этой реакции, является газообразным и имеет резкий запах, а серный калий может быть использован в различных отраслях промышленности и научных исследованиях.
Таким образом, взаимодействие серной кислоты и хлорида калия приводит к образованию серного калия и кислотного хлорида. Этот процесс сопровождается реакцией нейтрализации и образованием соли и воды.
Химические свойства серной кислоты
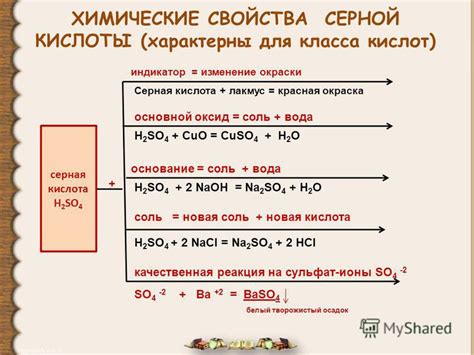
1. Кислотные свойства: Серная кислота является сильным кислотным соединением. Она образует водородные ионы, которые способны донорствовать протоны, делая раствор кислотным. Кислотные свойства серной кислоты проявляются при реакции с основаниями и металлами.
2. Реакция с основаниями: Серная кислота реагирует с основаниями, образуя соответствующие соли. Например, при реакции с гидроксидом натрия образуется сульфат натрия и вода:
- H2SO4 + 2NaOH → Na2SO4 + 2H2O
3. Реакция с металлами: Серная кислота реагирует с некоторыми металлами, образуя сульфаты металлов и выделяя водород. Например, при реакции серной кислоты с цинком образуется сульфат цинка и выделяется водород:
- H2SO4 + Zn → ZnSO4 + H2
4. Окислительные свойства: Серная кислота является сильным окислителем и способна окислять некоторые вещества. Она может окислять многие органические и неорганические соединения, например, превращая сероводород в элементарную серу:
- H2SO4 + H2S → S + 2H2O
5. Дегидратирующие свойства: Серная кислота обладает сильной дегидратирующей способностью. Она может вытягивать воду из других веществ и образовывать гидраты. Например, при реакции с сахарами серная кислота образует глюкозу и вода:
- H2SO4 + C6H12O6 → 6H2O + 6C + heat
Химические свойства серной кислоты делают ее полезной во многих отраслях промышленности, включая производство удобрений, пластмасс, химических реагентов и многого другого.
Физические свойства серной кислоты
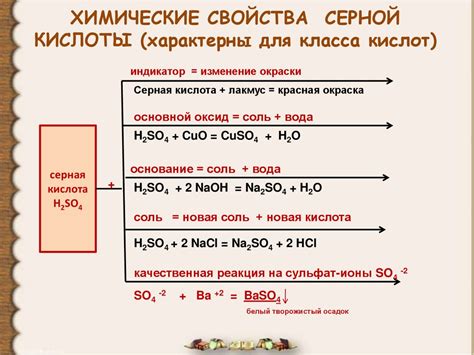
У серной кислоты есть несколько важных физических свойств, которые определяют ее поведение и применение в различных областях.
Цвет и запах: Серная кислота обычно представляет собой безцветную жидкость без ярко выраженного запаха.
Плотность: Серная кислота имеет высокую плотность, приближающуюся к 1,84 г/см3. Это делает ее тяжелой жидкостью.
Температура кипения: Кипение серной кислоты происходит при температуре около 337 °C.
Растворимость: Серная кислота хорошо растворима в воде, образуя концентрированный раствор с большим количеством ионов водорода.
Сильная кислотность: Серная кислота является одной из наиболее сильных неорганических кислот. Она способна диссоциировать в воде, образуя ионы водорода, что делает ее агрессивно коррозионной и опасной для работы.
Концентрированность: Концентрированная серная кислота, с концентрацией около 98%, является достаточно опасным химическим веществом, способным вызвать серьезные ожоги и повреждения при контакте с кожей или тканями.
Эти физические свойства делают серную кислоту важным реагентом во многих химических процессах и промышленных приложениях, а также потенциально опасным веществом, требующим особой осторожности при обращении.
Химические свойства хлорида калия

Хлорид калия обладает высокой растворимостью в воде. При растворении KCl распадается на калий и хлорид ион, обеспечивая электролитическую проводимость раствора. Это делает KCl полезным веществом для использования в электролитах, в трофолеевском шлеме, при производстве пищевых добавок и многих других областях.
Хлорид калия реагирует с некоторыми веществами, образуя новые соединения. Например, он может реагировать с серной кислотой (H2SO4), образуя калий сернокислый (K2SO4) и хлороводород (HCl). Этот процесс называется нейтрализацией и может быть использован для регулирования pH растворов. Также, KCl может реагировать с азотной кислотой (HNO3), образуя калий нитрат (KNO3) и хлороводород (HCl).
Хлорид калия также может быть использован для получения других химических соединений. Например, при нагревании с инсоляторами, такими как алюминий и фосфорус, KCl может образовывать соединения, такие как алюминий хлорид (AlCl3) и фосфид калия (K3P).
В природе хлорид калия встречается в виде минеральных отложений, таких как сильвинит и карналлит. Благодаря своей растворимости и наличию в природе, KCl является одним из наиболее распространенных источников калия.
| Формула | Молярная масса (г/моль) | Плотность (г/см³) | Температура плавления (°C) | Температура кипения (°C) |
|---|---|---|---|---|
| KCl | 74,55 | 1,98 | 770 | 1420 |
Изучение химических свойств хлорида калия позволяет нам лучше понять его роль и применение в различных областях науки и промышленности.
Физические свойства хлорида калия
Основные физические свойства хлорида калия включают:
- Температура плавления: 776 °C.
- Плотность: 1.98 г/см³.
- Растворимость: хлорид калия хорошо растворяется в воде. При комнатной температуре 34.2 г KCl растворяется в 100 мл воды. Раствор хлорида калия обладает электролитическими свойствами.
- Разложение: при нагревании хлорид калия распадается, выделяя хлороводород.
Хлорид калия имеет широкий диапазон применений, включая его использование в производстве питьевой воды, удобрений, стекла, лекарственных препаратов и многих других продуктов. Он также используется в научных и лабораторных исследованиях.
Применение серной кислоты и хлорида калия
Серная кислота, один из наиболее распространенных и важных химических продуктов, широко используется в производстве удобрений, взрывчатых веществ, синтетических материалов, бумаги, текстиля, пищевых и фармацевтических продуктов. Она также используется в электрохимических процессах, таких как гальваническое осаждение и зарядка аккумуляторов.
Хлорид калия, солевое соединение, используется в сельском хозяйстве как удобрение, так как обеспечивает растениям необходимые питательные элементы - калий и хлор. Он также широко применяется в медицине, в процессе диагностики и лечения различных состояний, таких как дефицит калия в организме.
Применение серной кислоты и хлорида калия также связано с их химическими свойствами. Серная кислота является сильным окислителем и растворителем, а хлорид калия является солевым соединением, обладающим высокой стабильностью и хорошей растворимостью. Эти свойства делают их полезными во многих химических процессах и применениях.
| Применение серной кислоты | Применение хлорида калия |
|---|---|
| Производство удобрений | Удобрение для сельского хозяйства |
| Производство бумаги и текстиля | Медицинское применение |
| Электрохимические процессы | Диагностика и лечение |
Использование серной кислоты и хлорида калия является неотъемлемой частью многих областей науки и промышленности. Эти вещества обладают уникальными химическими свойствами, которые делают их важными компонентами в различных процессах и приложениях.



