Растворение углекислого газа – это процесс, в котором молекулы углекислого газа (СО2) физически и химически взаимодействуют с молекулами воды.
Углекислый газ может растворяться в воде как физически, так и химически. Физическое растворение происходит при взаимодействии между молекулами газа и молекулами воды, при котором образуется гидратная оболочка вокруг молекулы газа. Этот процесс называется физической абсорбцией.
Химическое растворение углекислого газа происходит при взаимодействии между молекулами СО2 и молекулами воды, при котором образуются ионные комплексы. Вода в данном случае служит кислотным раствором и может образовывать ионы водорода (H+) и карбоната (СО3^2-). Такое растворение называется химической абсорбцией.
Растворение углекислого газа в воде играет важную роль в многих аспектах нашей жизни. Оно является основным механизмом передачи СО2 из атмосферы в океаны, что способствует регуляции климата на Земле. Также процесс растворения углекислого газа в воде играет важную роль в биологических системах, в частности, в поддержании кислотно-щелочного равновесия в организме.
Причины растворения углекислого газа в воде
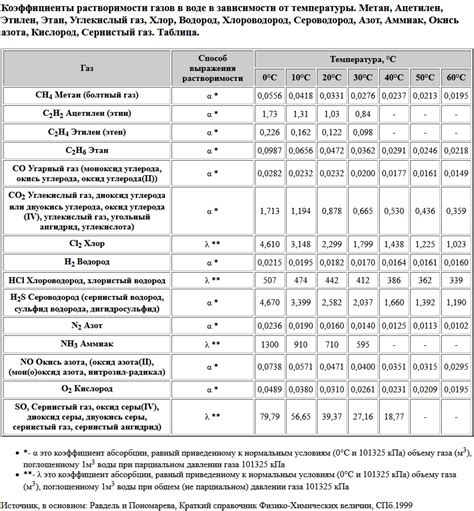
Главной причиной растворения углекислого газа в воде является химическое взаимодействие между молекулами СО2 и молекулами воды. Молекула СО2 обладает полярной структурой, что означает, что электронная плотность в молекуле неравномерно распределена. Это приводит к возникновению диполя и созданию электростатической силы притяжения между молекулами СО2 и молекулами воды.
Кроме того, углекислый газ может растворяться в воде благодаря процессу диссоциации, когда молекула СО2 разбивается на ионы. В результате реакции СО2 + Н2О ↔ H2CO3 ↔ HCO3- + H+, происходит образование карбоновой кислоты (H2CO3), которая в свою очередь может диссоциировать на ионы гидрогенкарбоната (HCO3-) и протона (H+).
Температура и давление также оказывают влияние на растворение углекислого газа в воде. При повышении температуры и снижении давления способность воды растворять углекислый газ уменьшается, а при понижении температуры и повышении давления – увеличивается.
Растворение углекислого газа в воде играет важную роль в природе и экологии. Этот процесс является основной причиной возникновения океанской кислотности и регулирует газовый баланс в атмосфере. Более того, растворение СО2 в воде является основой для физиологических процессов в организмах, таких как дыхание рыб и растений.
Физические свойства растворенного углекислого газа

Физические свойства растворенного углекислого газа зависят от его концентрации в растворе, температуры и давления. Однако, независимо от этих параметров, углекислый газ обладает несколькими характеристиками, важными для его понимания и использования:
- Кислотность (pH): Растворенный углекислый газ образует угольную кислоту (H2CO3), которая является слабой кислотой. Это влияет на pH раствора и может иметь значительное влияние на химические процессы, происходящие в воде.
- Растворимость: Углекислый газ имеет высокую растворимость в воде, что позволяет ему легко переходить из газообразной фазы в жидкую. Растворимость зависит от давления и температуры, и может быть определена с использованием различных физических моделей.
- Вязкость и плотность: Растворенный углекислый газ влияет на вязкость и плотность воды. Это может изменять гидродинамические свойства жидкости и оказывать влияние на ее теплообменные и транспортные свойства.
- Реакционная активность: Растворенный углекислый газ может участвовать в различных химических реакциях, особенно в присутствии катализаторов или при повышенной температуре и давлении. Это явление использовано в различных индустриальных процессах и технологиях.
- Эффект на окружающую среду: Углекислый газ является одним из главных веществ, способствующих парниковому эффекту и изменению климата. Растворение углекислого газа в океанах и других водных резервуарах может вызывать кислотификацию и иметь серьезные последствия для морской экосистемы.
Изучение физических свойств растворенного углекислого газа имеет важное значение для понимания его роли в природных и технических процессах, а также для разработки методов его использования и контроля в различных областях науки и промышленности.
Химические реакции при растворении углекислого газа в воде

- Протонирование углекислого газа:
- Автодиссоциация угольной кислоты:
- Протонирование гидрокарбоната:
- Диссоциация гидрокарбоната:
СО2 + H2O ⇌ H2CO3
Углекислый газ реагирует с водой, образуя угольную кислоту. Эта реакция является обратимой, то есть угольная кислота может распадаться на углекислый газ и воду.
H2CO3 ⇌ H+ + HCO3-
Угольная кислота может диссоциировать на ион водорода (протон) и ион гидрокарбоната (гидрогенкарбоната).
HCO3- + H2O ⇌ H2CO3 + OH-
Гидрокарбонат реагирует с водой, образуя угольную кислоту и гидроксид-ион.
HCO3- ⇌ CO32- + H+
Гидрокарбонат может диссоциировать на ион карбоната и ион водорода (протон).
Эти реакции являются важными для понимания процесса растворения углекислого газа в воде и его роли в природе.



