Металлическая связь – одно из фундаментальных понятий в химии и физике. Она лежит в основе множества свойств металлов, таких как электропроводность, теплопроводность, их способность образовывать сплавы и многое другое. Однако, насколько связь между атомами металла является направленной или ненаправленной, до сих пор остается вопросом, требующим глубокого анализа и исследования.
С позиции классической химии, металлическая связь является ненаправленной. Это означает, что электроны, образующие связь, свободно передвигаются по всей сетке металла без явного предпочтения определенных направлений. По этой теории, металлическая связь можно сравнить с облаком электронов, окружающим положительно заряженные ядра атомов металла. В этом случае, направленность связи отсутствует, и электроны распределяются равномерно во всех направлениях.
Однако, с развитием квантовой химии и появлением более точных подходов к описанию химических связей, стало понятно, что простое объяснение металлической связи как ненаправленной является упрощением. Современные исследования указывают, что металлическая связь все же обладает некоторой степенью направленности. Это связано с особенностями электронной структуры металлов и взаимодействиями электронов между собой и с положительно заряженными ядрами.
Роль электронов и кристаллической структуры в металлической связи
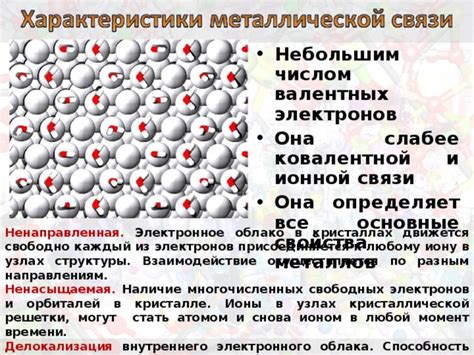
Основным строительным блоком кристаллической решетки металлов является катионный каркас, состоящий из положительно заряженных металлических ионов. Эти ионы образуют устойчивую трехмерную структуру благодаря металлической связи.
Однако сам по себе катионный каркас не обеспечивает устойчивость кристаллической структуры. Здесь на сцену выходят электроны – основные участники металлической связи. В отличие от других типов связи, металлическая связь не является направленной. Металлы способны образовывать сеть свободных электронов, которые могут передвигаться внутри кристаллической структуры металла. Эти электроны формируют так называемое "электронное облако", которое окружает положительно заряженные ионы катионного каркаса.
Электроны в металлической связи обладают высокой подвижностью, поэтому металлы обладают хорошей электропроводностью и теплопроводностью. Они могут легко перемещаться под влиянием электрического поля или взаимодействия с другими электронами. Также электроны определяют другие свойства металлов, такие как пластичность и оптические свойства.
Таким образом, металлическая связь основана на взаимодействии между положительно заряженными ионами металлического каркаса и свободными электронами. Кристаллическая структура металлов обеспечивает устойчивость этой связи и определяет их физические свойства. Электроны, в свою очередь, обеспечивают устойчивость кристаллической структуры и дают металлам их характерные свойства.
Свободные электроны и их влияние на направленность

В металлической решетке способность электрона к свободному движению зависит от энергетического состояния и его связей с другими электронами. Эти связи между электронами создают направленность в металлической связи.
Свободные электроны могут двигаться по металлической решетке в различных направлениях. Однако, из-за наличия направленных связей между электронами, они предпочитают двигаться вдоль определенных направлений. Это создает особую структуру свободных электронов в металле и определяет его проводимость и магнитные свойства.
Направленность свободных электронов влияет на различные свойства металлов, такие как электропроводность, теплопроводность и пластичность. Благодаря направленности свободных электронов металлы могут быть отличными проводниками электричества и тепла, а также обладать хорошей деформируемостью.
Взаимодействие электронов с кристаллической решеткой
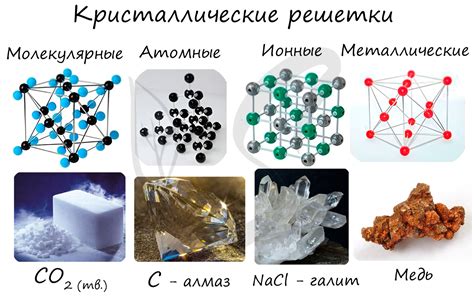
Металлическая связь обусловлена взаимодействием электронов с кристаллической решеткой металла. Кристаллическая решетка представляет собой систему атомов или ионов, которые располагаются в пространстве по определенным правилам.
В металлах внешние электроны свободно движутся внутри кристаллической решетки, формируя так называемую "электронную облако". Взаимодействие этих электронов с положительно заряженными ядрами атомов или ионов создает металлическую связь.
Электроны могут перемещаться вдоль кристаллической решетки металла благодаря наличию свободных мест в энергетическом спектре. В связи с этим, металлы хорошие проводники электричества и тепла.
Металлическая связь обладает определенной степенью направленности. Кристаллическая решетка создает потенциальный барьер для движения электронов, что определяет направленность их движения. Однако, в металлической связи электроны не привязаны к конкретным атомам, их движение является относительно свободным и не ограничено определенными направлениями.
Взаимодействие электронов с кристаллической решеткой также является основой для различных металлических свойств, таких как пластичность, проводимость и теплопроводность. Влияние внешних факторов, таких как изменение температуры или примесей, может повлиять на свойства металла путем изменения взаимодействия электронов с решеткой и их движения внутри металла.
Металлическая связь и ее направленность в контексте химической бондирующей теории

Однако, несмотря на отсутствие строгой направленности, металлическая связь все же обладает определенными характеристиками и особенностями. Одна из них - координационная окраска металла. Когда атомы различных металлов образуют металлическую сеть, некоторые электроны становятся локализованными около конкретных атомов. Это приводит к появлению цвета у металлов и их соединений.
Другой особенностью металлической связи является возможность образования металлических кластеров и кристаллических решеток. Кластеры представляют собой пространственные структуры, состоящие из атомов металла, которые связаны между собой через общие электроны. Кристаллические решетки образуются при упорядоченном расположении металлических атомов в кристаллической структуре.
| Металлическая связь | Ионная связь | Ковалентная связь |
|---|---|---|
| Отсутствие строгой направленности | Строгая направленность | Строгая направленность |
| Общие электроны | Передача ионов | Общие электроны |
| Координационная окраска | Электростатическое взаимодействие | Поделка электронов |
В контексте химической бондирующей теории, металлическая связь рассматривается как результат перекрытия диапазонов энергии электронов, что приводит к возникновению общих электроновной оболочки для всего металлического материала. Эти общие электроны формируют так называемое "море электронов", которое отвечает за металлические свойства металла, такие как высокая электропроводность и теплопроводность.
Таким образом, хотя металлическая связь не обладает строгой направленностью, она все же обладает определенными особенностями и является одной из основных химических связей в металлах и их соединениях.
Объяснение феномена направленности в металлической связи

Во-первых, металлы обладают большим количеством свободных электронов в своей валентной зоне. Эти свободные электроны, называемые электронами проводимости, не принадлежат ни одному конкретному атому, а могут свободно перемещаться по кристаллической решетке металла.
Во-вторых, электроны проводимости обладают отрицательным зарядом, а ядра металлических атомов – положительным зарядом. Такое специфическое распределение зарядов создает притягивающую силу между электронами и атомами металла. Именно эта притягивающая сила и является основной причиной существования металлической связи.
Но что делает металлическую связь направленной? В основе феномена направленности лежит определенное геометрическое расположение атомов металла. Кристаллическая решетка металла представляет собой жесткую структуру, в которой атомы металла расположены в определенном порядке. Это расположение создает возможность для образования металлической связи с определенным направлением.
Более того, атомы металла имеют неодинаковую величину радиуса, что приводит к образованию узлов и осей металлической решетки, устанавливающих определенное направление для электронных облаков проводимости. Это объясняет, почему металлическая связь обладает направленностью.
Таким образом, феномен направленности в металлической связи связан с геометрией кристаллической решетки металла и специфическим распределением зарядов между атомами металла и электронами проводимости.



